“… y seréis como dioses” Gen. 3, 6.
Pasó mucho tiempo desde que Aristóteles añadiera un quinto elemento (el éter) a los cuatro ya establecidos por Empédocles (aire, agua, tierra y fuego). En 1661 aparecía la obra “The Sceptical Chymist”, en la que Robert Boyle establecía el criterio moderno de elemento: una sustancia básica que puede combinarse con otras para formar compuestos. En 1799 Joseph Louis Proust mostró que había relaciones numéricas claras entre los pesos de los constituyentes de un compuesto dado, algo que John Dalton explicó en 1808 invocando la naturaleza atómica de la materia, remontándose a la teoría epicúrea que recogía las perspectivas de Leucipo y Demócrito. Fue Berzelius quien publicó una lista de pesos relativos (atómicos) de los elementos conocidos, tomando como unidad el peso del hidrógeno, algo que refinó Cannizzaro.
 Habiendo muchos elementos conocidos, se intentó relacionarlos en función de sus propiedades. A los intentos de Döbereiner (1816) y de Dumas (1859) y Newlands (1863), siguieron los trabajos de Lothar Meyer y, sobre todo, de Mendeléiev, quienes, independientemente, vieron que, en orden creciente de peso atómico, se alcanzaban periodicidades con respecto a las propiedades químicas. Ese orden permitió apreciar la existencia de “huecos” a ser rellenados por elementos aun no conocidos entonces.
Habiendo muchos elementos conocidos, se intentó relacionarlos en función de sus propiedades. A los intentos de Döbereiner (1816) y de Dumas (1859) y Newlands (1863), siguieron los trabajos de Lothar Meyer y, sobre todo, de Mendeléiev, quienes, independientemente, vieron que, en orden creciente de peso atómico, se alcanzaban periodicidades con respecto a las propiedades químicas. Ese orden permitió apreciar la existencia de “huecos” a ser rellenados por elementos aun no conocidos entonces.
Un gran hallazgo fue el de Moseley, quien, en 1914, estudió el espectro de emisión de rayos X producidos por distintos metales, viendo que su longitud de onda disminuía de forma regular al avanzar en la tabla periódica. Los elementos fueron entonces ordenados por algo distinto al peso relativo; lo fueron por un número de orden llamado atómico.
La mecánica cuántica permitió entender qué era subyacente al orden numérico y a la periodicidad de propiedades. El número atómico indica la cantidad de protones que hay en el núcleo de cada elemento y se asocia a la vez a la configuración electrónica responsable de sus propiedades químicas. El peso atómico acabó siendo menos importante, ya que depende también de la cantidad de neutrones y tiene que ver, por tanto, con propiedades físicas, pero no químicas, del elemento en cuestión.
A medida que se iban descubriendo elementos químicos, la tabla periódica se iba “completando” lo que sugería el poder predictivo de una buena clasificación. Los primeros 94 elementos se han hallado en la Naturaleza, aunque sea en cantidades traza. No ocurre así con los siguientes, que han tenido que ser “construidos” bombardeando elementos pesados con núcleos más ligeros en aceleradores de partículas.
En general, estos elementos “creados” son muy inestables pero no se descarta que otros, aun más pesados, puedan ser especialmente estables.
Muy recientemente se ha dado nombre a los últimos cuatro elementos conocidos, cuyos números atómicos son 113, 115, 117 y 118. Se completa así la séptima fila de la tabla periódica. ¿Se iniciará la octava?
¿En qué estriba el interés por obtener nuevos elementos? Hay razones pragmáticas (el caso del plutonio, fundamental para armas nucleares, muestra ese triste, inhumano, pragmatismo) pero en la investigación de la tabla periódica hay algo más, un fuerte atractivo epistémico y estético. Se trata de saber, de conocer lo elemental atómico (que sabemos que no es propiamente lo más elemental) en su diversidad, en su relación ordenada y periódica, intrínsecamente bella. También de alcanzar toda la diversidad existente, la completitud en este ámbito. Y esto supone plantear la cuestión del límite, ¿cuál sería el elemento de mayor número atómico con posibilidad de ser creado o encontrado? Por razones de mecánica cuántica, Feynman pensaba que sería el elemento 137. No deja de ser llamativo que la constante de estructura fina sea precisamente próxima a 1 / 137.
Los números atómicos ejercen una fuerte fascinación estética, casi pitagórica. Hubo un apasionado por la química, el neurólogo Oliver Sacks recientemente fallecido, que se refería a su edad biológica asociándole el nombre del elemento cuyo número atómico coincidiera con ella.
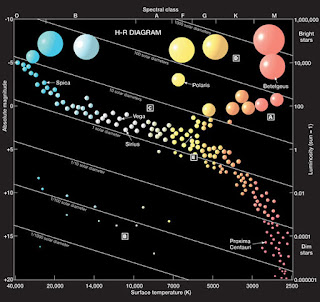 ¿De dónde surge la belleza? Tal vez de que la tabla periódica es ejemplar para mostrar la necesidad taxonómica, la que desarrolla la cuestión del "¿Qué?" inicial. Primero nombramos, después clasificamos, y eso lo hacemos con animales, plantas, minerales, cristales, estrellas… No se trata sólo de poner orden. La tabla periódica ilustra que es desde las clases que podemos dar el salto a las causas. El orden requiere la explicación. Otro ejemplo sugerente es el de la clasificación estelar del diagrama de Hertzsprung-Russell.
¿De dónde surge la belleza? Tal vez de que la tabla periódica es ejemplar para mostrar la necesidad taxonómica, la que desarrolla la cuestión del "¿Qué?" inicial. Primero nombramos, después clasificamos, y eso lo hacemos con animales, plantas, minerales, cristales, estrellas… No se trata sólo de poner orden. La tabla periódica ilustra que es desde las clases que podemos dar el salto a las causas. El orden requiere la explicación. Otro ejemplo sugerente es el de la clasificación estelar del diagrama de Hertzsprung-Russell.
Y surge una cuestión que suele plantearse más bien en matemáticas: ¿Estamos ante algo descubierto o creado? ¿Cabe una Química que sea, en cierto modo, platónica? Puede ocurrir que un elemento, como sucedió con el plutonio, sea creado antes de ser descubierto en la naturaleza en cantidades traza. ¿Pasará lo mismo con todos los elementos creados en el laboratorio? De no ser así, de no existir en la naturaleza, esa creación sería una mimesis que se ha quedado sin objeto que copiar y, en tal caso, tal creación sería algo propiamente humano, de tal modo que, a diferencia de otros ámbitos, en el de la Química esa antigua tentación de ser como dioses estaría en gran medida colmada.

